УРОК 9
ТЕМА: Взаємозв’язок між будовою електронних оболонок та властивостями хімічних елементів, простих речовин, сполук елементів з Гідрогеном та Оксигеном
Мета:
- сформувати поняття «атомний радіус», «електронегативність», уявлення про залежність властивостей елементів від їх положення в Періодичній системі;
- розвивати вміння писати електронні формули атомів і визначати властивості елементів за місцем в Періодичній системі;
- виховувати науковий світогляд.
Тип уроку: комбінований
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, плакати «Будова електронних оболонок атомів хімічних елементів», інтерактивна періодична таблиця Д. І. Менделєєва, дидактичні картки з завданнями, таблиця відносних електронегативностей.
ХІД УРОКУ
|
Структура уроку |
Вид діяльності |
||||||||||||
|
І. Організаційний етап ІІ. Перевірка домашнього завдання
Експрес-контроль Завдання 1 варіант Напишіть електрону конфігурацію та схему будови атому Мангану. 2 варіант Напишіть електрону конфігурацію та схему будови атому Мангану. ІІІ. Мотивація навчальної діяльності учнів Існує легенда, що одного разу побачивши «місце проживання» елементів чаклунка не бачивши жодної з речовин, які вони утворюють, назвала окремо метали та неметали. А ще вона сказала: «Ви всі хіба не бачите, це ж ніби планети, кругленькі, але різних розмірів, одна куля більша, інша менша, це залежить від їх властивостей.» - Як ви гадаєте це вигадка, чи можливо в словах чаклунки була істина? ІV.Оголошення теми та задач уроку V. Вивчення нової теми 1. Залежність металічних та неметалічних властивостей від будови зовнішнього електронного шару Розповідь вчителя 2. Поняття про електронегативність
3. 1. Введення поняття радіуса атома. 3. 2. Залежність властивостей елементів від розміру радіуса атома і положення елемента в періодичній системі. На основі розповіді вчителя діти створюють схему: «Зміна радіусів атомів в періодах»
« Зміна радіусів атомів в групах»
Збільшується кількість електронних рівнів
Збільшуються кількість атомів
Послаблюється протягування електронів до ядра
Послаблюється здатність приєднувати електрони
Збільшуються металеві властивості
VI. Закріплення знань
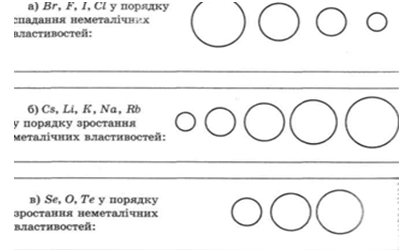
3.Розмістіть:
VIІ. Домашнє завдання Опрацювати матеріал параграфу, виконати завдання в зошиті письмове.
|
Фронтальне опитування Експрес-контроль
Легенда
Проблемне питання Коментар вчителя
Створення схем-опор І формулюван ня висновків
Завдання
Робота в групах
Коментар вчителя
|
||||||||||||